 Das Prinzip der Massenspektrometrie ist folgendes (Abbildung links, zur Vergrößerung anklicken: man verdampft das zu untersuchende Molekül und beschießt es dann in der Gasphase mit einem Elektron. Auf diese Weise erzeugt man ein geladenes Ion des Moleküls, das man mit einer entgegengesetzt geladenen Metallplatte anzieht und gleichzeitig auf eine Kreisbahn zwingt. Je nach Gewicht des Moleküls prallt es dabei an einer anderen Stelle der Metallplatte, dem so genannten Detektor, auf, woraus man Rückschlüsse auf dessen Masse ziehen kann.
Das Prinzip der Massenspektrometrie ist folgendes (Abbildung links, zur Vergrößerung anklicken: man verdampft das zu untersuchende Molekül und beschießt es dann in der Gasphase mit einem Elektron. Auf diese Weise erzeugt man ein geladenes Ion des Moleküls, das man mit einer entgegengesetzt geladenen Metallplatte anzieht und gleichzeitig auf eine Kreisbahn zwingt. Je nach Gewicht des Moleküls prallt es dabei an einer anderen Stelle der Metallplatte, dem so genannten Detektor, auf, woraus man Rückschlüsse auf dessen Masse ziehen kann.
Das Problem bei großen Molekülen ist, dass sie sich nicht verdampfen lassen. Den diesjährigen Nobelpreisträgern John Fenn und Koichi Tanaka gelang es, Verfahren zu entwickeln, die auch große Proteine in die Gasphase bringen und somit deren massenspektroskopische Untersuchung ermöglichten. Dazu lösen sie das Protein in Wasser und versprühen die Lösung in winzigsten Tröpfchen im Spektrometer. Das Wasser verdampft, und – voila – ist das Protein in der Gasphase. Das klingt einfach, ist aber in der technischen Realisierung äußerst schwierig.
Auf diese Weise ist es möglich, die Massen der Proteine exakt zu bestimmen, und da sie unter den Messbedingungen in kleinere Bruchstücke zerfallen, aus deren Analyse weitere Rückschlüsse auf deren Struktur ziehen.
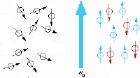 Die meisten Atome besitzen ein magnetisches Dipol, verhalten sich also wie kleine Kompassnadeln. In einem Magnetfeld kann man diese Kompassnadeln mit (parallel) oder gegen (antiparallel) die angelegte Feldstärke ausrichten, und die Energiedifferenz dieser beiden Zustände messen. Da die Stärke der magnetischen Dipole der Atome durch die räumliche Nähe anderer magnetischer Atome im Molekül beeinflusst wird, kann eine genaue Analyse der Energiedifferenzen zwischen dem parallelen und antiparallelen Zustand aller Dipole Aufschluss über die Struktur des Moleküls geben. Solche Messungen kann man in Lösungsmitteln wie Wasser durchführen, wodurch man den Bedingungen in einer Zelle sehr nahe kommen kann.
Die meisten Atome besitzen ein magnetisches Dipol, verhalten sich also wie kleine Kompassnadeln. In einem Magnetfeld kann man diese Kompassnadeln mit (parallel) oder gegen (antiparallel) die angelegte Feldstärke ausrichten, und die Energiedifferenz dieser beiden Zustände messen. Da die Stärke der magnetischen Dipole der Atome durch die räumliche Nähe anderer magnetischer Atome im Molekül beeinflusst wird, kann eine genaue Analyse der Energiedifferenzen zwischen dem parallelen und antiparallelen Zustand aller Dipole Aufschluss über die Struktur des Moleküls geben. Solche Messungen kann man in Lösungsmitteln wie Wasser durchführen, wodurch man den Bedingungen in einer Zelle sehr nahe kommen kann.
Diese Technik wurde durch den diesjährigen dritten Nobelpreisträger Kurt Wüthrich in nicht für möglich gehaltener Perfektion für Proteine entwickelt, so dass man nun ihre biologische Funktion, und vor allem ihre Wechselwirkung mit anderen Substanzen studieren und so neue Medikamente in rationeller Weise entwickeln kann.
Artikel zum Thema:
Streit um den Nobelpreis Chemie 2002 | Nobelpreis Chemie 2005 | Nobelpreis Chemie 2004 | Nobelpreis Chemie 2003 |Nobelpreis Chemie 2001
Links zum Thema:
Ein Massenspektrometer Simulator | Ein NMR-Spektroskopie Tutorium | Das Nobelpreis Internet Archiv