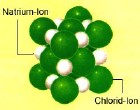
 Salze sind aus Ionen aufgebaut, etwa das gut bekannte Kochsalz (= Natriumchlorid) aus Natriumkationen Na+ und Chloridanionen Cl-. Im festen Zustand bilden Salze so genannte Ionengitter aus, in denen sich positive und negative Ionen regelmäßig anordnen. Aufgrund der elektrostatischen Anziehungskräfte zwischen positiven und negativen Ionen sind solche Gitter außerordentlich stabil. Wenn man ein Salz durch Erwärmen zum Schmelzen bringt muss man daher beträchtliche Mengen an Energie aufwenden, die so genannte Ionengitterenergie, um das Ionengitter zu zerstören. Umgekehrt wird dann natürlich die Ionengitterenergie frei, wenn ein Salz vom flüssigen zum festen Zustand erstarrt.
Salze sind aus Ionen aufgebaut, etwa das gut bekannte Kochsalz (= Natriumchlorid) aus Natriumkationen Na+ und Chloridanionen Cl-. Im festen Zustand bilden Salze so genannte Ionengitter aus, in denen sich positive und negative Ionen regelmäßig anordnen. Aufgrund der elektrostatischen Anziehungskräfte zwischen positiven und negativen Ionen sind solche Gitter außerordentlich stabil. Wenn man ein Salz durch Erwärmen zum Schmelzen bringt muss man daher beträchtliche Mengen an Energie aufwenden, die so genannte Ionengitterenergie, um das Ionengitter zu zerstören. Umgekehrt wird dann natürlich die Ionengitterenergie frei, wenn ein Salz vom flüssigen zum festen Zustand erstarrt.
Eine Flüssigkeit oder Schmelze (man verwendet den Begriff Schmelze bei Stoffen, die bei Raumtemperatur normalerweise fest sind) erstarrt normalerweise an ihrem Schmelzpunkt, etwa Wasser bei 0°C. Viele Flüssigkeiten kann man aber auch unterhalb ihres Schmelzpunkts abkühlen, ohne dass sie fest werden. Solche unterkühlten Flüssigkeiten bezeichnet man als metastabil, da ihr Erstarren plötzlich einsetzten kann. Oftmals kann das Erstarren einer unterkühlten Flüssigkeit auch gezielt ausgelöst werden, etwa dadurch, dass man einen Kristallisationskeim hinzufügt. Viele kennen vielleicht das Phänomen, dass bei einer Außentemperatur von –5°C eine Wasserpfütze plötzlich gefriert, wenn man sie mit einem Stab (= Kristallisationskeim) berührt.
 Die Kombination der oben beschriebenen Effekte, Freisetzung von Ionengitterenergie beim Erstarren eines Salzes und Unterkühlung von Flüssigkeiten, kann man auf einfache, aber sehr effektive Weise für die Konstruktion einer Taschenheizung nutzen, die ohne Strom oder Feuer auskommt. Festes Natriumacetattrihydrat, das Natriumsalz von gewöhnlichem Essig inklusive Kristallwasser (3 Moleküle Wasser pro Molekül Natriumacetat), wird bei 54°C flüssig (genauer gesagt löst sich das Salz in seinem eigenen Kristallwasser), doch kann die Schmelze bis auf etwa –10°C abgekühlt werden, ohne dass sie wieder fest wird. Setzt der Erstarrvorgang jedoch ein wird die Ionengitterenergie frei, und die Schmelze erwärmt sich bis zu ihrem Schmelzpunkt von 54°C und hält auch diese Temperatur, bis sie komplett erstarrt ist.
Die Kombination der oben beschriebenen Effekte, Freisetzung von Ionengitterenergie beim Erstarren eines Salzes und Unterkühlung von Flüssigkeiten, kann man auf einfache, aber sehr effektive Weise für die Konstruktion einer Taschenheizung nutzen, die ohne Strom oder Feuer auskommt. Festes Natriumacetattrihydrat, das Natriumsalz von gewöhnlichem Essig inklusive Kristallwasser (3 Moleküle Wasser pro Molekül Natriumacetat), wird bei 54°C flüssig (genauer gesagt löst sich das Salz in seinem eigenen Kristallwasser), doch kann die Schmelze bis auf etwa –10°C abgekühlt werden, ohne dass sie wieder fest wird. Setzt der Erstarrvorgang jedoch ein wird die Ionengitterenergie frei, und die Schmelze erwärmt sich bis zu ihrem Schmelzpunkt von 54°C und hält auch diese Temperatur, bis sie komplett erstarrt ist.
> > > WEITER zum zweiten Teil: Ein Knackfrosch als Auslöser
Bildnachweis:
Gitterenergie, mit freundlicher Genehmigung des Bayerischen Rundfunks (Bayern 3)